Wei Bing,Bai Hou,Jin Yizhe,Yang Zeyi
北京康比体育营养研究所(北京100029)
在过去的十年中,预防肥胖和控制已成为全球研究热点。目前的共识观点是,增加体育锻炼并限制卡路里摄入的行为疗法可以有效地减轻体重并改善由肥胖引起的代谢障碍。特别是,有氧运动可以促进脂肪酸氧化和能量供应,提高胰岛素敏感性,改善糖脂代谢,并调节各种与肥胖相关基因的表达。但是,长期以来,行为疗法并不容易持续,因此需要广泛探索其他辅助减肥方法。表皮列食物(EGCG)作为茶多酚的主要活性物质具有强大的抗氧化活性,可以有效地抵抗肿瘤并降低心血管疾病风险[1,2]。研究表明,EGCG可以改善肥胖和相关的代谢异常[3,4]。尽管对EGCG单体的研究数量有所增加,但有关体重减轻的大多数研究仍针对绿茶提取物或结合儿茶素。绿茶提取物或总儿茶素的特定作用无法完全解释EGCG的作用[5]。 L-Carnitine(LC)是已投放市场的“ Star”减肥产品,具有有争议的减肥效应[6]。研究表明,与单独使用相比,与LC和其他天然提取物相结合,例如异黄酮,莲花叶提取物等,可以更好地改善肥胖体的代谢状态[7]。
肉碱棕榈转移酶1(CPT1)是用于脂肪酸β-氧化的关键酶,它对整个脂肪酸氧化过程具有重要的调节作用。研究还表明,CPT1与体内脂肪沉积有一定的关系[8,9]。其表达水平的增加有助于增加脂肪酸分解并减少体内脂肪含量。这项研究验证了肥胖大鼠的锻炼eGCG和LC的干预效果,从而为肥胖症治疗和新减肥产品的发展提供了基础。
1材料和方法1.1实验动物和建立大鼠肥胖模型
174个4周大的桑兰格·戴利(Sprange-Dawley)雄性大鼠,体重为90-110 g,由中国人民解放军的实验室动物中心提供,许可证号:SCXK-(军事)2007-004。
在对大鼠的自适应喂养1周后,将20个随机选择为对照组并喂养普通饲料。其余的154个是模块制造组,并喂高脂饲料8周。喂养环境:温度19-23℃,湿度为40-60%,白天和晚上交替在12h/12h。在模型期间,每个星期一都称重体重,并在8周后比较了两组大鼠的重量变化。体重的大鼠大于高脂饲料饲料组中对照组平均重量的20%的大鼠,被选为具有成功建模的大鼠。
饲料由北京Huafukang Biotechnology Co.,Ltd。提供,辐照和消毒,许可证编号:SCXK北京2009-0008。普通饲料中每种营养素的能量供应比为20%蛋白质,70%的碳水化合物和10%的脂肪;高脂饲料中每种营养素的能量供应比为20%蛋白质,35%碳水化合物和45%的脂肪。
1.2实验方法
1.2.1动物组
从成功制定该模型的大鼠中随机选择50只肥胖大鼠,并将其随机分为5组,每组中有10组,并且仍被喂食高脂饲料以进行减肥治疗实验。饲料配方和饲料环境处于同一成型期。特定组如下:肥胖对照组(F):喂食高脂饲料并倒入蒸馏水;简单的运动组:进食高脂饲料,跑步机运动,蒸馏水;锻炼与EGCG组(E)结合:饲料高脂进料,跑步机运动,EGCG;锻炼与LC组(L)结合:每天喂养高脂饲料,跑步机运动,LC;运动与EGCG和LC组(EL)结合:饲料高脂饲料,跑步机运动,EGCG+LC。 7周后执行执行,并测试了测试指标。该实验在北京联合大学完成。

1.2.2练习以及EGCG和LC干预方法
(1)运动负荷方案:选择中和低强度的跑步机训练,请参阅贝德福德方法[10],将载荷设置为16 m/min,60 min/day,强度大约等于最大氧气摄入量的58%。锻炼5天,休息2天,每周训练7周。第1周是自适应训练,从6 m/min和10分钟开始,以2 m/min和10分钟的速度增加到设定的负载。筛选了不习惯跑步机并悬挂太长时间的大鼠,最终将6只保留在每组中。正式的实验阶段从第2周开始。
(2)给药计划:EGCG,纯度≥95%,购自Zhejiang Qianshengkang Pharmaceutical Co.,Ltd。,生产批号:EG95-00110314H。 L-Carnitine Tartrate购自Guangzhou Rikang Edible Chemical Co.,Ltd。,其生产批号:D030-1102010。
EGCG和LC补充均以80 mg/kg体重计算。在实验过程中,饲料容量为1 ml/100g体重(重量超过500g的大鼠的烤肉能力与5 ml成正比),F和S组中的大鼠在1 ml/100g体重的蒸馏水中可食用。
1.2.3试剂和仪器
甘油三酸酯试剂盒购自Nanjing Jiancheng Company; CPT1 Rabbitan购自Santa Company; TFJZOL试剂购自Invitrogen Company; SuperscriptTM III逆转录酶购自Invitrogen Company; 5×RT缓冲液购自Invitrogen Company; 2.5毫米DNTP混合物购自Hytest Co.,Ltd。 2x PCR Master Mix购自SuperArray Company。
壁画低温冷冻离心机:Thermo Company; Multi-Skan3微板读取器:Thermo Company;迷你P-4电泳坦克:骑兵公司;电泳仪器:Bio-Rad Company;横向脱色振动器:Qilin Bell Company;酸度仪PH211:Hanna Company;电动组织均匀机器:Fluka Company; DK-8D电恒温恒温储罐:上海塞克辛实验仪器有限公司。
1.2.4检测指标和方法
实验后,在训练的最后一天之后,快速持续12小时,用2%的戊巴比妥腹膜腹膜腹膜腹膜注射给体重称重,解剖了腹腔,迅速将大肝裂片分开,将其切开的组织切成小块,然后将其填充到冰冻的储存管中,然后将其填充到液体中,并将其放入液体中,并将其放入液体中,并将其放置在液体中。冻结进行测试。
内脏脂肪系数的测定:隔离在胃肠道上附着的大足体,肠系膜和周围脂肪,清洁三个脂肪的地方并用滤纸吸收干燥,称重,内脏脂肪系数=脂肪系数=脂肪重量(G)/体重(G)×100。
肝甘油三酸酯(TG)水平的测定:首先切割约100毫克的组织块并称重。将酶剂溶解在10 ml缓冲液中,排列为工作液体,并静止10分钟。根据Folch方法和改进,将甲醇,氯仿和正常盐水当作6:7:14的提取液体混合。根据1 mg的组织加入提取溶液:900μl提取物并在冰水中均匀。均匀剂在4度冰箱中固定超过12小时后,将其离心4000 r/min,持续10分钟,然后用移液器小心地提取下提取物;将10μl下提取物溶液加入1 ml的工作液体,并将其孵育10分钟;孵育后,将其离心3000 r/min,持续10分钟,取上清液,然后将其倒入比色杯中,在500 nm处涂色,然后测量吸光度值;根据标准曲线计算甘油三酸酯含量。
通过参考Trizol试剂盒(从Invitrogen购买)的指示提取肝CPT1 mRNA表达的实时定量PCR方法(从Invitrogen购买)以及通过琼脂糖凝胶电泳和紫外线光检查器的浓度和纯度来提取RNA。将2μg的RNA与0.5μg/μl的寡核(DT)18作为随机底漆合成cDNA。底漆5.0底漆设计软件用于设计引物,PCR引物长度为278 bp,序列为:5'gtgggagcgactcttcaatact3''Oustpream cpt1和5'caaaaataggtcccgcgcgacactt3'下游。实时PCR反应系统为10μL,0.5μl的正向引物和反向引物(10μM),2μl的模板,其余的添加了无RNase的无RNase水。反应条件为:stage1:(1×)95℃,10分钟; stage2 :( 40×)步骤1:95℃,10 s,step2:60℃,60 s; stage3:(1×)95℃,10 s,60℃,60 s,95℃,15 s;慢慢加热至99℃。 Guanjia Gene GAPDH用作内部参考,在样品中要测量的基因值除以样品中内部参考的值。获得的比率是要在样品中测量的基因的相对含量。

蛋白质印迹方法检测肝脏中CPT1蛋白的表达:提取NP-40方法,并在垂直电泳仪器(Bio-Rad)上通过相同体积的20μg蛋白样品分离蛋白,并转移至NC膜(Millipore)。用抗体稀释(Santa Cruz,Rabbit抗小鼠CPT1)以1:5000的稀释原代抗体。将原代抗体在4°C下孵育过夜,洗涤5次,并用抗体稀释以1:10,000稀释二抗(Jackson,HRP共轭山羊抗兔IgG; HRP共轭兔抗goat抗goat IgG)。将二抗在室温下孵育40分钟。彻底洗涤1×TBST后,使用ECL试剂盒(Santa Cruz)使用发光发育,并将X射线膜暴露于光,并扫描和量化每个频段的相对灰色值。总LAB量化软件读取iod(集成的光密度值),结果表示为目标蛋白与内部参考集成的光密度值的集成光密度值的比率。
1.3统计分析
使用SPSS19.0统计软件进行测试,并表示为平均值±标准偏差。将每个实验组的数据与单向方差分析进行比较,并在符合方差的同质性时,使用LSD方法进行了多个比较。显着性水平为p <0.05。非常重要的水平是P2结果2.1重量,内脏脂肪系数,肝TG
表1显示,S组,S+E组,S+L组,S+E+L组的重量显着低于F组(P
表1每组大鼠的体重,内脏脂肪系数,肝TG含量的比较
2.2肝CPT1基因和蛋白质表达
如表2所示,与F组相比,S组的CPT1 mRNA表达没有显着差异(P> 0.05)。 S+E组,S+L组和S+E+L组中CPT1 mRNA的表达显着高于F组和S组(p 0.05)。 S+L组和S+E+L组中CPT1蛋白的表达显着高于F组的表达(P

表2 CPT1 mRNA和不同组大鼠肝脏中的蛋白质表达水平
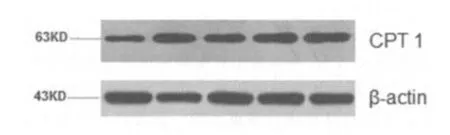
图1不同组肝组织中CPT1蛋白的表达
3个讨论
先前的研究表明,[11],运动训练,尤其是有氧运动,可以促进体内脂肪含量的减少。其他研究证实,有氧运动可以抑制脂肪的合成过程并促进疏远[12]。此外,有氧运动可以通过骨骼肌促进FFA的摄入,增加线粒体β氧化相关酶的表达和活性,并促进脂肪分解[13]。
EGCG是绿茶多酚的主要组成部分。近年来的研究表明,EGCG可以改善高脂饮食引起的肥胖症。 EGCG可以通过刺激热量产生,促进能量消耗,促进脂肪酸氧化,减少食物摄入以及抑制3T3-L1的前脂肪细胞分化[14,15]来发挥一定的减肥作用。关于EGCG的影响与运动对体重的影响很少,并且存在争议[16]。
LC是体内长链脂肪酸进入线粒体并氧化的重要因素。补充LC可以促进脂肪的利用并具有减肥效应。有许多关于LC和运动对体重的影响的研究。许多国内外实验证明,LC在体重减轻中具有良好的辅助作用[17,18]。周丁基[19] 16个肥胖女性被随机分为对照组,实验组进行了为期12周的脂肪损失实验。两组进行有氧运动每周五次,每次1小时。每天对实验组补充2G LC,对照组是安慰剂。 12周后,与对照组相比,体重,体内脂肪含量,血脂水平,呼吸商(RQ)等相比,实验组的体重显着降低(呼吸商越低,燃烧的脂肪越多),表明LC可以有效地改善有氧运动对促进肥胖女性脂肪代谢的影响,并增强体重减轻的影响。
在这项研究中,S,S+E和S+L组中大鼠的重量显着低于F组的大鼠,这表明有氧运动和营养干预与有氧运动相结合是有效的减肥方法。但是,S+E和S组和S组之间没有显着差异。与F和S组相比,S+E+L组的重量显着降低,每个组的体重减轻为S组。
这项研究的结果还表明,S+E+L组大鼠的内脏脂肪系数显着低于F组的大鼠,这表明有氧运动的综合使用,EGCG和LC对减少内脏脂肪的积累具有显着影响。
在这项研究中,S+L和S+E+L组中的肝TG含量明显低于F,S和S+E组中的肝脏含量,这表明可以通过添加LC消除肝脏中的脂肪积累过多。肝脏是脂质和脂肪的重要代谢器官。当人体缺乏LC时,它将导致长链脂肪酸的氧化,这也会导致肝脏和脂肪肝脏中脂肪的过量积累。增加LC摄入量,调节脂肪代谢,促进脂肪氧化,并消除体内或器官中过量或积累的脂肪。
CPT1是用于脂肪酸β氧化的关键酶,它对整个脂肪酸氧化过程具有重要的调节作用。研究表明,在由甲酸引起的非酒精性脂肪肝模型中,线粒体CPT在大鼠肝脏中的活性受到显着抑制,并且CPT1和CPT2 mRNA的表达也显着降低[20]。同时,研究表明CPT1表达水平与体内脂肪含量有关。表达水平升高有助于增加脂肪酸分解并减少体内脂肪含量[21]。
在这项研究中,S组中的CPT1基因和蛋白质与F组相比显示出趋势的增加,但没有显着差异,表明该研究的运动强度在一定程度上改善了线粒体β氧化相关酶的表达和活性。 S+E,S+L和S+E+L组中大鼠的CPT1 mRNA水平明显高于F和S组中的CPT1大鼠,而S+L和S+E+L组中大鼠的CPT1蛋白表达显着高于F组中的CPT1蛋白,这表明EGCG,CARNITINE和两者的组合可以增强锻炼和减肥的效果。此外,与EGCG结合的运动对肥胖大鼠的CPT1蛋白没有显着影响,因此S+L和S+E+L组中CPT1蛋白水平的变化更依赖于LC对CPT1蛋白的影响。
4摘要
运动的综合使用,EGCG和LC可以减轻体重,减少内脏脂肪并改善肝甘油三酸酯水平。改变肝CPT1表达可能是其机制之一。

[1]Amin AR,Wang D,Zhang H等人通过天然化合物( - ) - epigallocatechin-3-gallate和luteolin的结合来增强抗肿瘤活性:p53.j Biol Chem的潜在作用。 2010,285(45):34557-34565。
[2] 2] Zheng J,Lee HC,Bin Sattar MM等。表格洛卡汀-3-gallate对阿霉素诱导的心肌细胞损伤的心脏活性作用。EURJ PHORMACOL,2011,652(652(1-3)(1-3):82-88。
[3]Boschmann M,Thielecke F.肥胖男性中表瓜蛋白3-gallate对生热和脂肪氧化的影响:一项试验研究。
[4]4]Lee MS,Kim CT和Kim Y.绿色茶( - ) - epigallocatechin-3-gallate通过调节饮食诱导的肥胖小鼠脂肪组织中多个基因表达的调节。
te茶儿茶素的二甲状腺酯酯减少了与脂肪酸同步rats.biosci Biotechnol BiioChem Chems.biosci BiioChem Chemss.5] ikeda I,Hamamoto R,Uzu K等减少肝脂肪的沉积以及与脂肪酸同步rats.biosci Biotechnol BioChems.biotechnol Biiochem Chems.biocci BiioChem Chems.555,2005,69(5)的活性。
[6]Villani RG,Gannon J,Self M.Rich PA:l-肉碱补充与有氧训练相结合并不能促进现代肥胖女性体重减轻。IntJ Sports Nutr练习Metab,2000,1000,10:199-207。
[7]7] Yun Jung Kim,Keun-Young Kim,Min Sun Kim.A藤黄果水提取物的混合物,大豆肽和L-肉碱的混合物减少了高脂饮食中肥胖的大鼠内脏脂肪质量的积累。
[8]MORASH AJ,MCCLELLAND GB。在禁食期间,carnitine Palmitoyltransferase(CPT)I的调节在Rainbow Trout(Oncorhynchus Mykiss)的禁食过程中促进了线粒体脂肪酸氧化的增加。PhysiolBiochem Zool。
[9] Zhao SM,Ren LJ,Chen L等。脂质代谢相关基因在猪肌肉组织中导致不同肌内脂肪沉积物的差异表达。Lipids,2009,44(11):1029-1037。
[10]Bedford TG,Tipton CM,Wilson NC等。大鼠的最大氧气消耗及其随着各种实验性的变化。Japplphysiol,1979,47(6):1278-1283。
[11] Zhang Yuan,Qi Zhengtang,Ding Shuzhe。线粒体脂肪酸氧化在运动骨骼肌中对脂肪代谢的影响。武汉体育研究所杂志,2008,42(2):56-61。
[12]AOI W,NAITO Y,HANG LP等。进行的规范运动可以通过改善肝脂质代谢来防止高核饮食诱导的脂肪肝。BiochemBiophysres res Commun,2011,413(2):330-335。
[13]Bradley NS,Snook LA,Jain SS等。
[14] Han Chao,Fan Xiaobing,Wang Shaokang等。实验研究对肥胖大鼠体重减轻的作用研究。现代医学,2008,36(3):197-199。
[15]Bose M,Lambert JD,Ju J等。主要的绿茶多酚,( - ) - 高脂化小鼠中的肥胖,代谢综合征和脂肪肝疾病,抑制epigallocatechin-3-gallate。
[16]Hill AM,Coates AM,Buckley JD等人EGCG减少肥胖受试者的腹部脂肪?J Am Coll,2007,26(4):396S-402S。
[17] L-肉碱对肥胖青少年体重的全面控制的影响。大都大学杂志,Shanxi(自然科学版),2010,26(4):83-84。
l-carnitine对肥胖,糖尿病和作为细胞生成的辅助的效果。
[19]周dingxi。 L-肉碱与有氧运动对肥胖女性脂肪代谢的影响。天津体育学院杂志,2004,19(4):60-62。
[20]Miyazawa S,Furuta S,Hashimoto T.通过喂养卵巢酸来还原大鼠肝脏线粒体的β-氧化能力。BiochimBiophys Acta,1982,711(3)(3):494-502。
[21]21]Takeuchi H,Matsuo T,Tokuyama K等。饮食中脂肪类型对棕色脂肪组织的β-氧化和脑神经膜Na+通道密度的影响。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请联系本站,一经查实,本站将立刻删除。如若转载,请注明出处:https://www.bjkytsjk.com/html/tiyuwenda/23216.html